高等学校卒業程度認定試験問題2012年 第2回 化学Ⅰ化学Ⅰ問題化学Ⅰ解答 解説(詳しくは教科書を見てください)問1) 有機物質の原料は石油で、炭素化合物。 紙の主成分は炭素。 答えは①。 問2) 発生した気体を石灰水に通して白くにごるのは、二酸化炭素。 硫酸銅(Ⅱ)無水物の白色粉末が青くなるのは、水。 答えは④ 問3) コバルトの電子の数は27で、2+となるのは、電子が2個減るので、 25-2=23 答えは① 問4) 周期表 18 族元素は希ガス元素。 答えは② 問5) イオンからなる物質 陽性の強い元素と陰性の強い元素の化合物。 硫酸カルシウムはイオン結合。 二酸化ケイ素は共有結合。ケイ素は4価の元素。 亜鉛は金属結合。 黒鉛は共有結合。炭素はは4価の元素。 ヨウ素は分子結晶。 答えは② 問6) エチレンC2H4 2 mol に含まれる水素原子の物質量(mol数)は、 2 [mol]×4=8 [mol] 気体の水素分子はH2 だが、 水素原子の物質量(mol数)は8 [mol] 答えは⑤ □2 無機物質 問1) 水素は,大型ロケットの燃料や( A 燃料電池)に用いられている。 また,非金属である窒素や塩素などと( B イオン結合)をし, アンモニアや塩化水素などの化合物をつくる。 実験室では( C 亜鉛)などの金属に希硫酸を反応させて発生させる。 正解は③. 問2) 2 族元素の単体や化合物に関する。 ① ベリリウムとマグネシウムは, 1 価の陽イオンになりやすい。 2価の陽イオンになりやすい。× ② マグネシウムは,熱水や高温の水蒸気とは反応しない。 マグネシウムは加熱すると、発火する。× ③ 炭酸カルシウムを強く熱すると,分解して二酸化炭素を生じる。 ○ ④ ストロンチウムは,黄緑色の炎色反応を示す。 深赤となる。黄緑色の炎色反応はバリウム。× ⑤ 硫酸バリウムは,水によく溶ける。 白い沈殿物になる。× 答えは③. 問3) 鉄の化合物とその色 塩化鉄(Ⅲ) 黄褐色なので、白色× 酸化鉄(Ⅲ) 赤さびなので、黒色× 四酸化三鉄 黒さびなので、赤褐色× 水酸化鉄(Ⅱ) 緑白色なので、黒色× 水酸化鉄(Ⅲ) 赤褐色○。 よって、正解は⑤。 問4) アルミニウムイオンAl~3+はNH3と錯イオンを生成しない。 亜鉛イオンZn~3+はNH3錯イオンを生成する。 したがって、亜鉛イオンにアンモニアを加えると、 水酸化亜鉛Zn(OH)2の白色沈殿をじるが、 さらにアンモニアを加えると、無色透明になる。 答えは③。 □3 有機化合物 問1) 炭化水素は,炭素原子を骨格とした化合物であり, 炭素原子どうしが( A 共有)結合によって結合し, さまざまな構造の化合物になる。 (電子荷4の物質は共有結合) また,炭素原子間の結合には単結合だけでなく, 二重結合や三重結合のような( B 不飽和)結合もある。 (不飽和炭化水素) さらに,炭素原子どうしが次々に結合できるため, 有機化合物の種類はとても( C 多い)。 11の答えは⑤. 問2) 官能基 -OH ヒドロキシ基 エタノール、メタノール、フェノール、 -CHO アルデヒド基 アsトアルデヒド、 -COOH カルボキシ基 酢酸 したがって、12の答えは④. 問3) メタンCH4 ① 常温で,赤褐色・無臭の固体である。× 無色、無味、無臭。 ② 水に溶けやすい。×。燃焼すると水が生成。 ③ 分子は,正四面体の構造をしている。○ ④ 酸素と反応しにくく燃えない。×。燃える。 ⑤ 塩素と反応し,メタンの水素原子が塩素原子と 置き換わる付加反応がおこる。× 付加反応は、二重結合や三重結合などの不飽和結合が開いて、 他の原子や原子団が新たに結合する反応。 メタンCH4は単結合なので、付加反応はおきない。 したがって13の答えは③. 問4) ジアゾ化。 アゾ染料として用いられる( A 橙赤)色のp.ヒドロキシアゾベンゼンは, アニリンの( B ジアゾ)化で生成する塩化ベンゼンジアゾニウムの水溶液に, フェノールを水酸化ナトリウム水溶液に溶かしたものを加えると生成する。 (カップリング) したがって、14の答えは①. □4 問1) 水酸化ナトリウムの溶解熱 与式に値をそのまま代入するのであるが、 温度変化=27.5-25=2.5℃ を代入する。 15の答えは③. 問2) 中和滴定 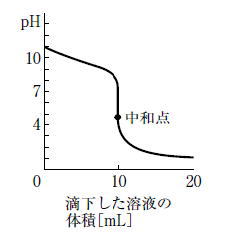 グラフがほとんど垂直になるpH飛躍がある。 中和点をすぎた後のpHが7以下なので、滴下した溶液は酸性なので、 滴下した溶液は0.1 mol/L 塩酸(強酸)。 中和点がpHは7より小さいので、 強酸と弱塩基との中和なので、 滴定する溶液は弱塩基のアンモニア水10 mLとなる。 16の答えは④. 問3) 電離度が大きいほうが酸としての性質が強い。 したがって、17の答えは⑤. 問4) ア:過酸化水素は酸化剤として働いている。 イ:硫黄原子Sの酸化数;-2 → 0 [酸化された] ウ:酸素原子Oの酸化数;-1 → -2 [還元された] エ:硫化水素は還元剤として働いている。 したがって、18の答えは①. 問5) 水に硫酸を加えて電気分解をすると、 陰極:水素 陽極:酸素 が発生。 水に水酸化ナトリウムを加えて電気分解をすると、 陰極:水素 陽極:酸素 が発生。 19の答えは②. 問6) マンガン乾電池 電池は,酸化剤と還元剤を両極として導線で結び, そこで起こる酸化還元反応による電子の出入りを 電気エネルギーとして取り出せるようにしたものである。 例えば,マンガン乾電池では,図のように 酸化マンガン(Ⅳ)を( A 正)極の物質, 亜鉛を( B 負)極の物質として用いている。 ( B 負)極の亜鉛がイオンになる際に電子を放出し, 電子が導線を通って( A 正)極に移動し, 酸化マンガン(Ⅳ)を( C 還元)している。 このときの電子の移動が電気エネルギーとして利用される。 酸化マンガン(Ⅳ)は電気伝導性が良くないので、 炭素粉末と混ぜ合わせて電解液を加えて練り、 正極合剤にし、正極とする。 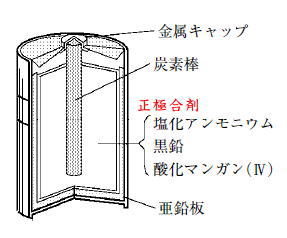 したがって、20の答えは②. |