崅摍妛峑懖嬈掱搙擣掕帋尡栤戣2013擭丂戞侾夞丂壔妛嘥壔妛嘥栤戣壔妛嘥夝摎 夝愢乮徻偟偔偼嫵壢彂傪尒偰偔偩偝偄乯栤侾乯丂敿摫懱偺尨椏偼働僀慺乮僔儕僐儞乯Si丄僎儖儅僯僂儉Ge側偳丅 丂丂丂丂擇巁壔働僀慺SiO2偼愇塸僈儔僗偱岝僼傽僀僶乕偺尨椏偵側傞丅 栤俀乯丂忬懺曄壔丅乮拞妛儗儀儖乯 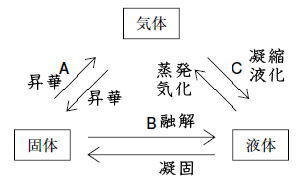 栤俁乯丂婥懱偺忬懺曽掱幃 丂丂丂丂俹倁亖値俼俿丂偱俹丆倁丆俿偑堦掕側偺偱丄 丂丂丂丂mol悢n偑堦掕偲側傞偺偱丄梕婍撪偺暘巕悢偼摨偠丅 栤係乯丂弮暔幙偐崿崌暔偺栤戣 丂丂丂丂嘆悈偼弮暔幙偱悈慺偲巁慺偺壔崌暔丅 丂丂丂丂嘇悈巁壔僫僩儕僂儉悈梟塼偼悈偲悈巁壔僫僩儕僂儉偺崿崌暔丒丒丒仜 丂丂丂丂丂墫巁丄婓棸巁偺悈梟塼傕悈偲偺崿崌暔 丂丂丂丂嘊墫巁偼弮暔幙偺悈偲弮暔幙偺墫壔悈慺偺崿崌暔丅 丂丂丂丂嘋僆僝儞侽3偼巁慺偺摨慺懱偱弮暔幙丅 丂丂丂丂嘍柍怓摟柧側僈儔僗偼擇巁壔働僀慺SiO2偱扨懱偱偼側偔壔崌暔丅 栤俆乯丂嘆乣嘋傪擱從偝偣傞偲CO2偼1mol敪惗丅 丂丂丂丂嘍僄僞儞C2H6傪擱從偝偣傞偲 丂丂丂丂丂擇巁壔扽慺丂2CO2丂偼2mol敪惗偡傞丅 丂丂丂丂丂俆偺摎偊偼嘍 栤俇乯丂拞妛儗儀儖 丂丂丂丂嬥偼嬥懏偱堷偭挘傞偲恓嬥偺傛偆偵墑傃傞偺偱丄丂摎偊偼嘇 仩俀丂柍婡暔幙 栤侾乯丂拞妛儗儀儖 丂丂丂丂婓棸巁偼垷墧傗儅僌僱僔僂儉傪梟偐偟悈慺傪敪惗偡傞偺偱丄摎偊偼嘍 丂丂丂丂嘆丂擲惈偑戝偒偄偼偍偦傜偔擹棸巁丠偺偙偲側偺偱丄亊 丂丂丂丂嘇丂婓棸巁偼嫮偄巁惈偱偁傝丄僈儔僗傪怤偝側偄丅亊丅 丂丂丂丂嘊丂媧幖惈丟擹棸巁偵偼媧幖惈丄扙悈嶌梡偑偁傞丅亊丅 丂丂丂丂嘋丂壛擬偟偨擬擹棸巁偼摵傪梟偐偡丅 丂丂丂丂丂丂摵偼俫傛傝僀僆儞壔孹岦偑彫偝偄偺偱婓棸巁偵梟偗側偄丅亊丅 栤俀乯丂僴乕僶乕丒儃僢僔儏朄 丂丂丂丂拏慺N2偲悈慺H2傪怗攠傪梡偄偰崅埑丄崅壏偱捈愙斀墳偝偣 丂丂丂丂傾儞儌僯傾傪惛惢偡傞曽朄丅 丂丂丂丂丂 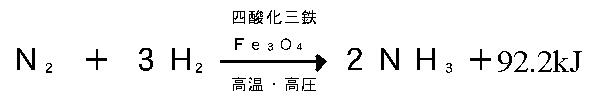 丂丂丂丂俉偺摎偊偼嘆偺傾儞儞儌僯傾 栤俁乯丂摵偵娭偡傞栤戣 丂丂丂丂嘆丂斾廳亖8.9丂寉偔偼側偄丅丒丒丒亊 丂丂丂丂嘇丂扨懱偺怓偼愒宯偺怓偱惵枴偼偍傃偰偄側偄丅丒丒丒亊 丂丂丂丂嘊丂揹慄傗崌嬥偵傕偪偄傜傟傞丅丒丒丒仜 丂丂丂丂嘋丂姡揹抮偺晧嬌偼垷墧倅値側偳丅丒丒丒亊 丂丂丂丂嘍丂摵偼俫傛傝僀僆儞壔孹岦偑彫偝偄偺偱墫巁偲斀墳偟側偄丅丒丒丒亊 栤係乯丂悈巁壔傾儖儈僯僂儉Al(OH)3 丂丂丂丂傾儖儈僯僂儉僀僆儞傪娷傓悈梟塼偵 丂丂丂丂悈巁壔僫僩儕僂儉悈梟塼傑偨偼傾儞儌僯傾悈傪壛偊傞偲丄 丂丂丂丂敀怓僛儕乕忬偺捑揳偑偱偒傞丅 丂丂丂丂丂Al^3+ 亄 3OH~- 仺丂Al(OH)3 丂丂丂丂悈巁壔僫僩儕僂儉NaOH傪夁忚偵壛偊傞偲丄 丂丂丂丂丂Al(OH)3偼Na[AL(OH)3]偲側偭偰 丂丂丂丂梟偗偰偟傑偆丅 丂丂丂丂丂Al(OH)3 + NaOH 仺丂Na[AL(OH)3] 丂丂丂丂10偺摎偊偼丂嘇偺悈巁壔僫僩儕僂儉 仩俁丂桳婡壔崌暔 栤侾乯丂嵒摐偼擇摐椶C12H22O11偲昞偝傟傞扽悈壔暔側偺偱桳婡壔崌暔丅嘍傪慖傇丅 栤俀乯丂侾壙傾儖僐乕儖偼侾暘巕拞偵僸僪儘僉僔婎-OH傪侾屄傆偔傓傕偺偱 丂丂丂丂丂儊僞僲乕儖丄僄僞僲乕儖側偳丄 丂丂丂丂丂 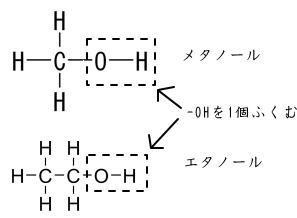 丂丂丂丂俀壙傾儖僐乕儖偼侾暘巕拞偵僸僪儘僉僔婎-OH傪俀屄傆偔傓傕偺偱 丂丂丂丂丂僄僠儗儞僌儕僐乕儖側偳丅 丂丂丂丂丂  丂丂丂丂俁壙傾儖僐乕儖偼侾暘巕拞偵僸僪儘僉僔婎-OH傪俁屄傆偔傓傕偺偱 丂丂丂丂丂僌儕僙儕儞側偳丅 丂丂丂丂丂  丂丂丂丂偟偨偑偭偰丄12偺摎偊偼嘋丏 栤俁乯丂儊僞儞丂丂丂俠俫4偼惓巐柺懱 丂丂丂丂僄僠儗儞丂丂俫2C=CH2偼暯柺宍 丂丂丂丂傾僙僠儗儞丂俫亅俠佭俠亅俫偼捈慄宍 丂丂丂丂偟偨偑偭偰侾俁偺摎偊偼嘇丏 栤係乯丂墫慺傪壛偊偰墫傪惗偠傞朏崄懓壔崌暔丅 丂丂丂丂傾僯儕儞偼庛墫婎惈偱巁偲斀墳偟偰墫傪偮偔傞丅 丂丂丂丂傾僯儕儞偼墫巁偲斀墳偟偰傾僯儕儞墫巁墫偵側傞丅 丂丂丂丂丂丂俠6俫5-NH2 + HCl 仺丂俠6俫5-NH3^+ Cl^- 丂丂丂丂摎偊偼嘋丏 仩係丂 栤侾乯丂俻倠俰偼恾偵帵偝傟偰偄傞偲偍傝丄 丂丂丂丂儊僞儞俠3俫86傪擱從偟偨偲偒偺擬丅 丂丂丂丂偟偨偑偭偰丄15偺摎偊偼嘊丏 栤俀乯丂僿僗偺朄懃乮憤擬検曐懚偺朄懃乯 丂丂丂丂乽斀墳擬偼丄斀墳偺宱楬偄傛傜偢丄斀墳偺嵟弶偺忬懺偲嵟屻偺忬懺偱寛傑傞丅乿 丂丂丂丂丂 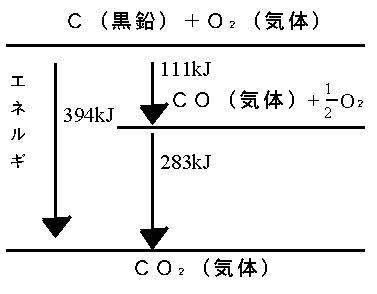 丂丂丂丂丂丂C 亄 O2 = CO2 + 394kJ 丂丂丂丂亅乯CO + (1/2)O2 = CO2 + 183kJ 丂丂丂丂亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅亅 丂丂丂丂丂丂C 亄 (1/2)O2 = CO + 111kJ 丂丂丂丂偟偨偑偭偰丄侾俇偺摎偊偼嘆丏 栤俁乯丂僌儔僼傛傝 丂丂丂丂丂a偼巁1mol偵墫婎1mol偱拞榓丒丒丒丒(1) 丂丂丂丂丂b偼巁1mol偵墫婎2mol偱拞榓丒丒丒丒(2) 丂丂丂丂偡傞偙偲偑傢偐傞丅 丂丂丂丂昞傛傝丄 丂丂丂丂丂(2)偺巁1mol偵墫婎2mol偱拞榓偡傞斀墳偼丄 丂丂丂丂嘋丄嘍偺棸巁偲悈巁壔僫僩儕僂儉偺惓墫斀墳乮棸巁僫僩儕僂儉偺惗惉乯丅 丂丂丂丂丂H2SO4 + 2NaOH 仺丂Na2(SO4) + 2H2O 丂丂丂丂偨偩偟棸巁偲悈巁壔僫僩儕僂儉偺巁惈墫斀墳乮棸巁悈慺僫僩儕僂儉偺惗惉乯偼晄揔偩偑丄 丂丂丂丂b偺墫婎偑10mL偺帪揰偱丄pH偼俈埲壓傪恾帵偟偰偄傞偺偱昁偢偟傕晄揔摉偱偼側偄丅 丂丂丂丂丂H2SO4 + NaOH 仺丂NaHSO4 + H2O 丂丂丂丂嘋丄嘍偺偆偪丄巁1mol偵墫婎1mol偱拞榓偡傞斀墳偼丄 丂丂丂丂嘋偺恷巁偲悈巁壔僇儕僂儉偺斀墳乮恷巁僇儕僂儉傪惗惉乯丅 丂丂丂丂丂CH3COOH + KOH 仺丂CH3COOK + H2O 丂丂丂丂偟偨偑偭偰丄17偺摎偊偼嘋丏 栤係乯丂尨巕偺巁壔丄娨尦偼巁壔悢偺憹尭偱敾抐偡傞丅 丂丂丂丂丂尨巕偺巁壔悢偑憹壛丟巁壔偝傟偨丅 丂丂丂丂丂尨巕偺巁壔悢偑尭彮丟娨尦偝傟偨丅 丂丂丂丂傾偺俫丟丂亄丂仺丂0丂丂乵娨尦偝傟偨乶 丂丂丂丂僀偺Cu丟丂0丂仺丂2+丂丂乵巁壔偝傟偨乶 丂丂丂丂僂偺俫丟丂亄丂仺丂+丂丂乵巁壔傕娨尦傕偝傟側偐偭偨乶 丂丂丂丂偟偨偑偭偰丄18偺摎偊偼嘊丏 栤俆乯丂悈偺揹婥暘夝 丂丂丂丂侾俠乮僋乕儘儞乯偼侾俙偺揹棳偑侾昩娫棳偝傟偨偲偒偺揹婥検丅 丂丂丂丂丂丂俻乵俠乶亖倝乵俙乶亊倲乵倱乶 丂丂丂丂0.1A偺揹棳傪9650昩棳偡偲 丂丂丂丂丂丂俻乵俠乶亖965乵C乶 丂丂丂丂僼傽儔僨乕掕悢傪俥偱昞偡偲丄 丂丂丂丂丂丂俥亖96500[C/mol] 丂丂丂丂e~-偼丂965/96500 = (1/100)[mol] 丂丂丂丂梲嬌丗O2丗e~- = 侾丗係亖倶[mol]丗(1/100)[mol] 丂丂丂丂丂O2丗倶亖(1/400)[mol] 丂丂丂丂丂婥懱1mol = 22.4[L/mol]側偺偱丄 丂丂丂丂丂O2亖(1/400)[mol]亊22.4[L/mol] 丂丂丂丂丂丂亖0.056[L]=56[mL] 丂丂丂丂堿嬌丗H2丗e~- = 侾丗俀亖倶[mol]丗(1/100)[mol] 丂丂丂丂丂H2丗倶亖(1/200)[mol] 丂丂丂丂丂婥懱1mol = 22.4[L/mol]側偺偱丄 丂丂丂丂丂H2亖(1/200)[mol]亊22.4[L/mol] 丂丂丂丂丂丂亖0.112[L]=112[mL] 丂丂丂丂偟偨偑偭偰丄侾俋偺摎偊偼嘊丏 栤俇乯丂揹抮 丂丂丂丂俙偼巁壔娨尦斀墳側偺偱丄嘇偐嘍 丂丂丂丂嘇偐嘍偺俛偼偄偢傟傕丄僟僯僄儖揹抮 丂丂丂丂(-)Zn|ZnSO4aq||CuSO4aq|Cu(+) 丂丂丂丂偟偨偑偭偰丄棸巁垷墧悈梟塼偵偼垷墧斅傪偄傟丄 丂丂丂丂棸巁摵乮嘦乯悈梟塼偵偼摵斉傪偄傟傞偺偱丄 丂丂丂丂俀侽偺摎偊偼嘍丏 |